联系热线
关于医用内窥镜 硬性内窥镜 第4部分:基本要求,主要遵循的是国家标准《医用内窥镜 硬性内窥镜 第4部分:基本要求》(YY 0068.4-2009)。以下是对该标准的详细解读:
一、YY 0068.4-2009标准概述
标准号:YY 0068.4-2009
英文名称: Medical endoscopes. Rigid endoscopes. Part4:Fundamental requirement
替代标准: 被YY 0068.4-2009/XG1-2023代替;部分代替YY 0068-1992
中标分类: 医药、卫生、劳动保护>>医疗器械>>C40医用光学仪器设备与内窥镜
ICS分类: 医药卫生技术>>11.040医疗设备
发布部门: 国家食品药品监督管理局
发布日期: 2009-12-30
实施日期: 2011-06-01
二、YY 0068.4-2009标准介绍
?YY 0068.4-2009标准?是《医用内窥镜硬性内窥镜》的第4部分,主要规定了医用硬性内窥镜的基本要求,适用于医用硬性内窥镜的设计、制造和评价?1。该标准由国家食品药品监督管理局(现国家市场监督管理总局药品监督管理局)发布,发布时间为2009年12月30日,实施时间为2011年6月1日?。
标准范围和主要内容
YY 0068.4-2009标准的主要内容包括:
光学性能和机械性能?:制造商应确保硬性内窥镜符合YY 0068.1(光学性能及其测试方法)和YY 0068.2(机械性能及其测试方法)的要求?。
电气安全?:硬性内窥镜应满足GB 9706.218中适用的要求,试验方法按GB 9706.1-2020中8.8.3的方法进行?。
生物相容性?:硬性内窥镜插入人体部分的材料应根据GB/T 16886.1的原则和要求进行生物安全性评价,以证明具有良好的生物相容性?。
无菌提供产品?:对于无菌提供的产品,其包装应符合GB/T 19633(较终灭菌医疗器械的包装)的要求?。
较新修订内容
2023年,国家药监局发布了关于YY 0068.4-2009标准的修改单,对部分条款进行了修订和更新,以确保标准的适用性和有效性。主要修订内容包括:
将GB 9706.1-2007《医用电气设备 第1部分:安全通用要求》更新为GB 9706.1-2020《医用电气设备 第1部分:基本安全和基本性能的通用要求》?。
将GB 9706.19《医用电气设备 第2部分:内窥镜设备安全专用要求》更新为GB 9706.218《医用电气设备 第2-18部分:内窥镜设备的基本安全和基本性能专用要求》?。
将《中华人民共和国药典》2005年版二部的方法更新为《中华人民共和国药典》的方法?。
三、YY 0068.4-2009适用范围
?YY 0068.4-2009《医用内窥镜 硬性内窥镜 第4部分:基本要求》适用于医疗目的的硬性内窥镜的设计、制造和评价??。该标准规定了硬性内窥镜的基本要求,包括光学性能、机械性能、电气安全、生物相容性等方面的具体要求?。
主要内容
?光学性能和机械性能?:制造商应确保硬性内窥镜符合YY 0068.1(光学性能及其测试方法)和YY 0068.2(机械性能及其测试方法)的要求?。
?电气安全?:硬性内窥镜应满足GB 9706.218中适用的要求。对于含目镜罩的内窥镜,如果声称其目镜罩与插入部分进行了电隔离处理,那么隔离部分的电介质强度应通过相应的试验进行验证?。
?生物相容性?:硬性内窥镜插入人体部分的材料应根据GB/T 16886.1的原则和要求进行生物安全性评价,以证明具有良好的生物相容性?。
?无菌提供、包装、标签和随附资料?:对于无菌提供的产品,其包装应符合GB/T 19633(较终灭菌医疗器械的包装)的要求;产品的标签和随附资料应清晰、准确,并提供足够的信息以供使用者正确、安全地使用内窥镜?。
四、YY 0068.4-2009的重要意义
?YY 0068.4-2009《医用内窥镜 硬性内窥镜 第4部分:基本要求》的重要意义主要体现在以下几个方面?:
首先,?该标准为硬性内窥镜的设计、制造和评价提供了基本框架?。YY 0068.4-2009规定了医疗目的硬性内窥镜的基本要求,适用于医用硬性内窥镜的各个方面,确保其质量和安全性?。
其次,?标准的内容涵盖了光学性能、机械性能、电气安全、生物相容性等多个方面?。制造商必须确保硬性内窥镜符合YY 0068.1(光学性能及其测试方法)和YY 0068.2(机械性能及其测试方法)的要求。此外,硬性内窥镜还需满足GB 9706.218中适用的要求,确保电气安全;其插入人体部分的材料需根据GB/T 16886.1的原则和要求进行生物安全性评价,以证明良好的生物相容性?。
较后,?标准的修订和完善确保了其适用性和有效性?。随着科技和医疗技术的进步,YY 0068.4-2009标准也在不断修订和更新,例如将GB 9706.19更新为GB 9706.218等,以确保与较新的国家标准和行业标准保持一致?。
这些措施不仅提高了硬性内窥镜的质量和安全性,还为医疗器械的生产和使用提供了明确的指导和规范,保障了医疗设备的有效性和安全性。
综上所述,医用内窥镜 硬性内窥镜 第4部分:基本要求,主要遵循YY 0068.4-2009标准,该标准在适用范围、主要内容等方面都有明确规定,对于保障电工电子产品环境试验 具有重要意义。
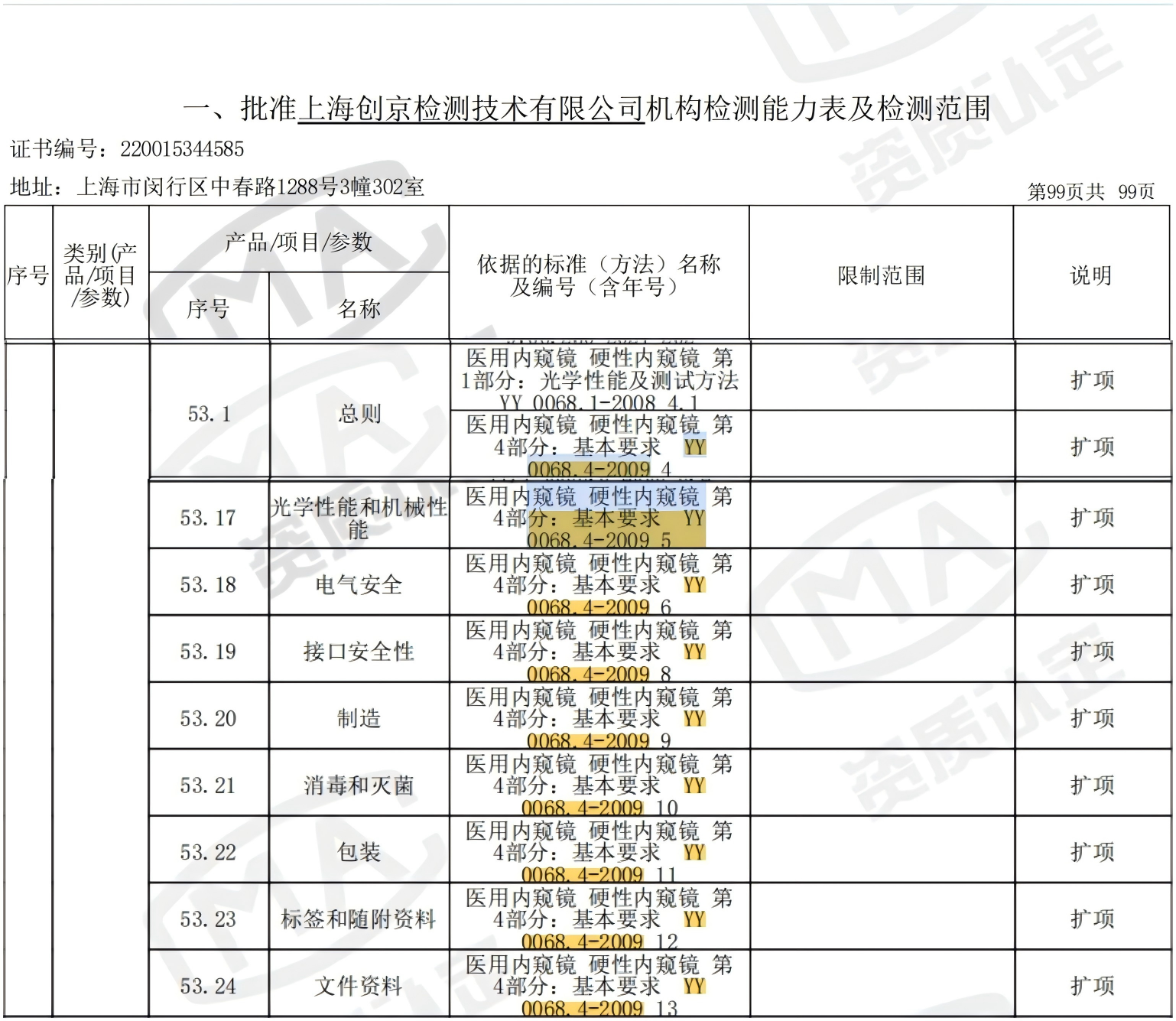
五、创京检测YY 0068.4-2009标准及实验能力
关于创京检测
上海创京检测技术有限公司成立于2018年,是一家专注于医疗器械产品注册上市的第三方检测机构,已获得国家CNAS和CMA双C资质,检测报告获得国家药监局、省药监局、审评中心认可。20年行业服务经验,与GE、迈瑞、联影、罗氏、西门子、徕卡、LG、飞利浦、美国哈希等医疗器械行业龙头企业建立了长期良好的合作伙伴关系。公司拥有专业的检测设备,可根据客户不同的需求,灵活组合出较合适的检测方案。创京检测严格按照国家药品监督管理局医疗器械标准管理中心的要求运行。作为国内专业检测服务企业的代表之一,上海创京检测技术有限公司以"专业、精准、高效、创新"为核心价值观,致力于成为行业内的领军企业,为客户提供更加优质、全面、高效和专业的检测服务。
创京检测严格按照国家药品监督管理局医疗器械标准管理中心的要求运行。公司拥有独立核心实验室:10米法电磁兼容实验室、3米法电磁发射半电波暗室、3米法全电波暗室、电磁干扰屏蔽室、静电测试屏蔽室、电磁干扰抗扰度屏蔽室、电气安全实验室、可靠性实验室、振动运输实验室、光学实验室、高频手术设备检测实验室、超声设备检测实验室,主营服务:EMC电磁兼容、安规测试、环境可靠性、体外诊断(IVD)、医用电气设备注册检测和咨询等。