联系热线
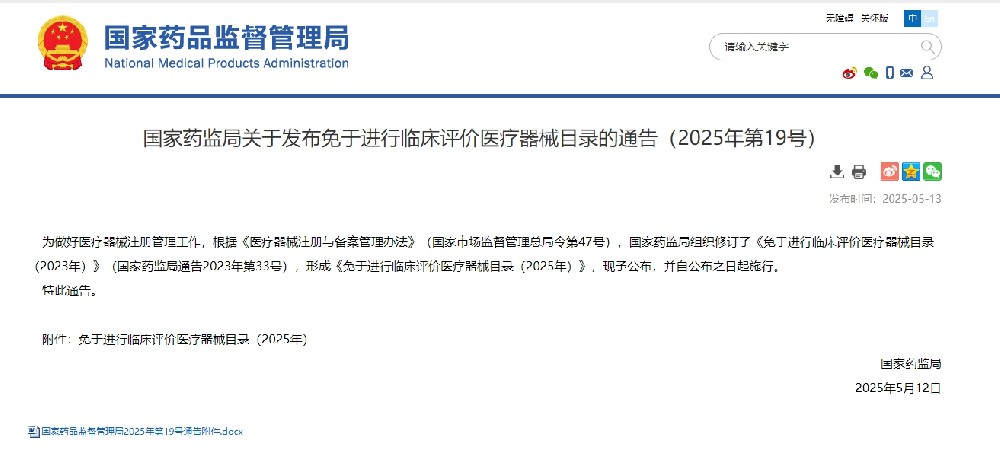
5月13日,国家药监局正式发布《免于进行临床评价医疗器械目录(2025年)》,据统计,《目录(2025)》涉及1047项医疗器械产品,其中,“新增”的产品有28项,“对产品描述进行修订”的产品有25项。自公布之日起施行。旨在优化医疗器械注册流程,推动行业创新与安全并重。
目录共涉及1047项医疗器械,涵盖Ⅱ类和Ⅲ类医疗器械产品,其中“新增”的产品有28项,包括个性化3D打印手术模型、放射治疗配套器械、脊柱内窥镜等Ⅱ类医疗器械与输送型颅内球囊扩张导管、房间隔穿刺鞘、透析用留置针等Ⅲ类医疗器械。
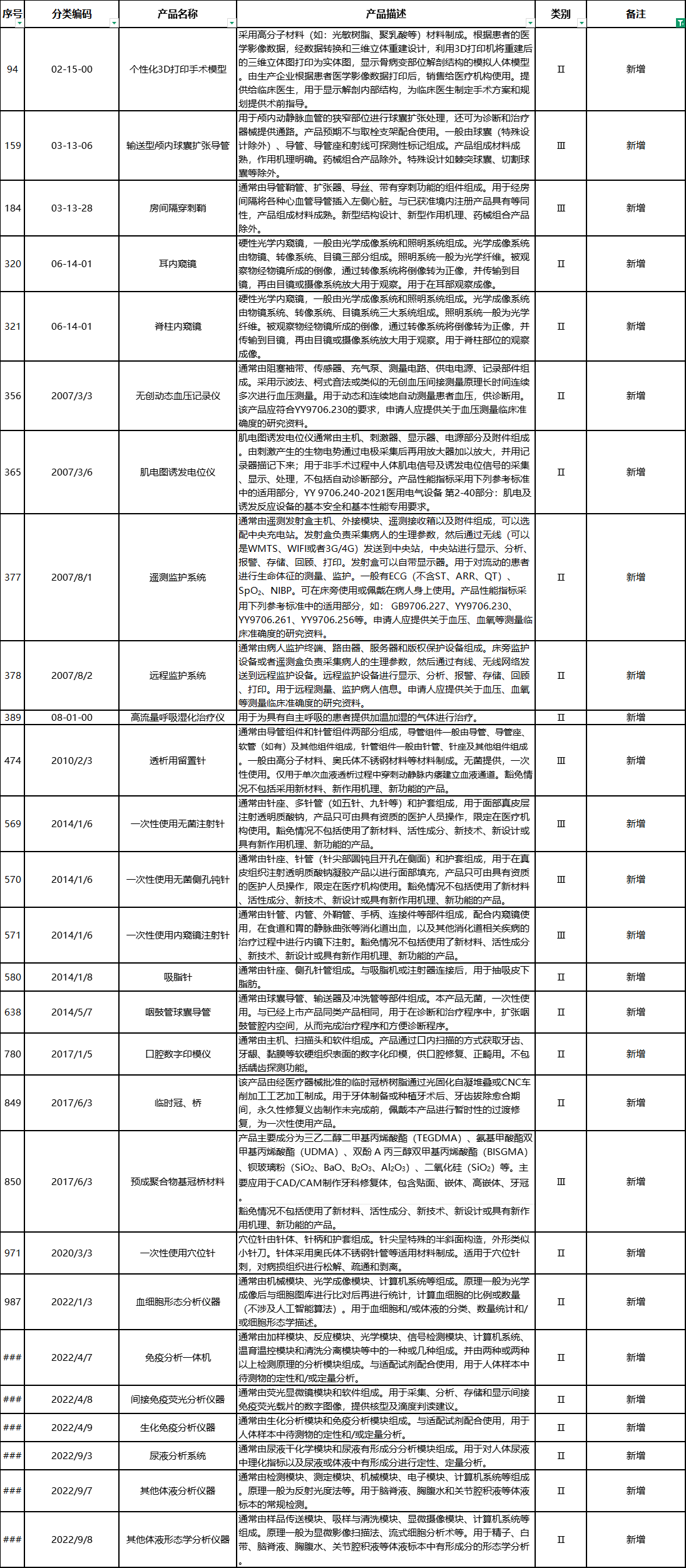
“对产品描述进行修订”的产品有25项,涉及一次性使用高频手术设备用阴极板、高频手术附件、3D打印截骨导板等Ⅱ类医疗器械与高频手术设备、血管内回收装置、金属锁定接骨板等Ⅲ类医疗器械。
“对产品名称进行修订”的产品有3项,分别为免疫层析分析仪器、免疫散射浊度分析仪器、幽门螺旋杆菌呼气分析仪器等Ⅱ类医疗器械。

“对产品名称和产品描述进行修订”的产品有2项,分别为电子膀胱输尿管肾盂内窥镜、角度型金属接骨板;前者为Ⅱ类医疗器械,后者为Ⅲ类医疗器械。

“对分类编码和产品描述进行修订。”的产品1项,,为Ⅱ类医疗器械的一次性使用胸腔引流管及穿刺套件。

此外,“修订管理类别和分类编码”的产品也仅有1项,为Ⅱ类医疗器械的经颈静脉肝内穿刺器械。

关于创京检测
创京检测专注于医疗器械检测,公司拥有多项权威资质认证,已获得国家CNAS和CMA双C资质,在⾏业内具备⾼度公信⼒。在检测能⼒⽅⾯,公司检测范围⼴泛,涵盖EMC电磁兼容、安全性能测试、环境可靠性、软件测试、体外诊断(IVD)等各类医疗器械的注册检测和咨询等。出具权威资质的检验检测报告,已获得国家药监局 、省药监局 、审评中⼼的认可,为医疗器械在性能、安全性、有效性等⽅⾯把关。

创京检测严格按照ISO/IEC17025打造实验室管理体系。公司拥有独⽴核⼼实验室:10⽶法电磁兼容实验室、3⽶法电磁发射半电波暗室、3⽶法全电波暗室、电磁⼲扰屏蔽室、静电测试屏蔽室、电磁⼲扰抗扰度屏蔽室、电⽓安全实验室、可靠性实验室、软件测试实验室、振动运输实验室、光学实验室、⾼频⼿术设备检测实验室、超声设备检测实验室。可随时迅速响应各⾏业客⼾在各领域的不同需求,提供近距离、本地化的专业服务。
创京检测,让医疗器械注册与检测更简单!